|
关注微信公众号:biowolf_cn,回复“TMB”,获取本推文12篇TMB研究文献。 TMB的诞生 有赖于基因测序技术的进步,纪念斯隆-凯特琳癌症中心(MSKCC)的Jedd D. Wolchok和Timothy A. Chan领导的研究团队,尝试从肿瘤基因组学的角度回顾性地探索这一重要问题。 既然免疫治疗是否有抗癌效果,主要依赖于免疫细胞对癌细胞特异性抗原的识别;那么,从理论上讲,那些携带基因突变越多的癌症患者,癌细胞产生的新抗原越多,被免疫细胞识别的可能性更高。也就是说,肿瘤组织的突变负荷(tumor mutational burden,TMB)越高,患者或许从免疫治疗中获益越多。 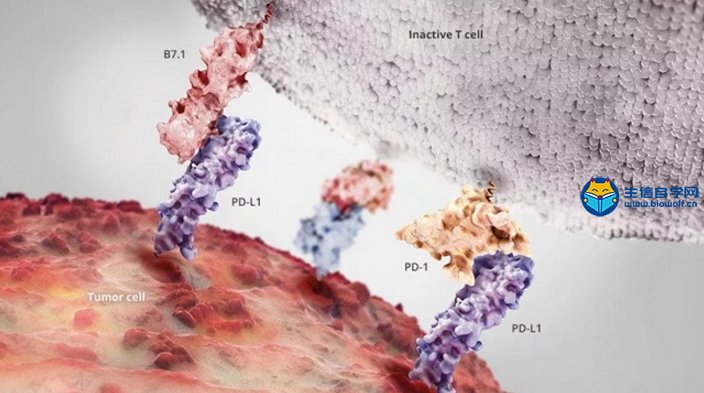 入门学习TMB肿瘤突变负荷,可以挖掘TCGA数据库: 《TCGA数据库肿瘤突变负荷TMB分析》 2014年,通过分析接受过CTLA-4抗体治疗癌症患者的全外显子(WES)测序数据,研究人员研究了TMB与治疗效果之间的关系[1]Genetic Basis for Clinical Response to CTLA-4 Blockade in Melanoma。 很幸运,他们发现了TMB与免疫治疗效果之间的关系,但是遗憾的是单独依赖肿瘤突变负荷,不足以预测患者的预后。这个研究也证实了,一直以来被认为对癌症的发展方向没左右能力的“乘客突变”,极有可能是肿瘤是否响应免疫治疗的“免疫决定因素”这一假说。也为用外显子测序指导免疫治疗提供了理论依据。这也是TMB首次邂逅免疫治疗。 伴随着2014年下半年,两款PD-1抗体分别获得FDA的上市批准。Timothy A. Chan又带领研究团队分析了肿瘤突变与PD-1抗体治疗响应之间的关系。 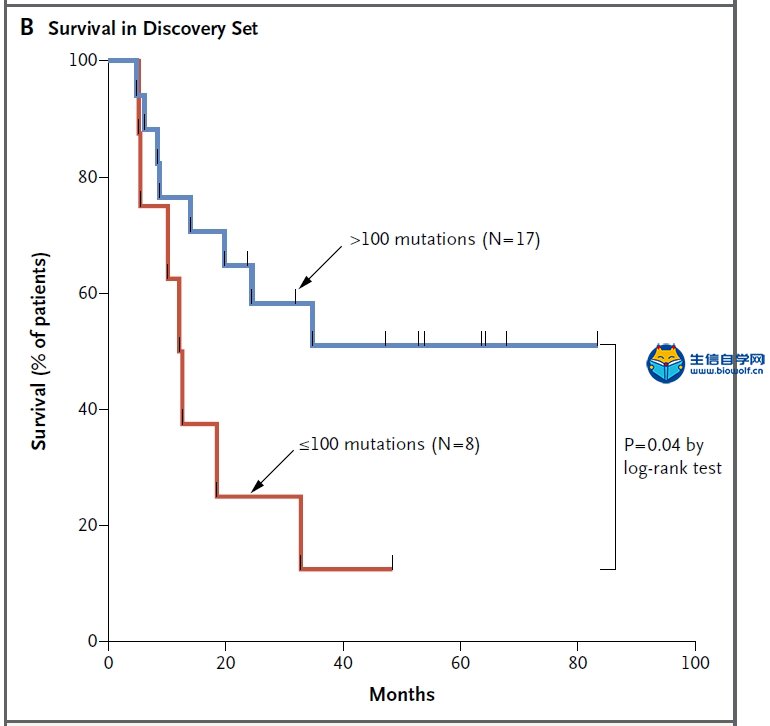 不出意外,在两个队列的回顾性研究中,再次借助全外显子测序(WES),Timothy A. Chan发现,在接受PD-1抗体治疗的非小细胞肺癌患者中,肿瘤中较高的非同义突变负担与客观反应提升,持久的临床益处和无进展存活相关。2015年初,这项临床回顾性研究结果发表在《科学》上[2]Mutational landscape determines sensitivity to PD-1 blockade in non-small cell lung cancer。  在TMB走向巅峰的过程中,最让人震惊的事件发生在前两年。 2016年,施贵宝(BMS)宣布其PD-1抗体nivolumab在非小细胞肺癌III期临床Checkmate-026中没有抵达主要临床终点[https://www.ascopost.com/News/43820]。对于那些PD-L1≥5%,且未经治疗的晚期肺癌患者,nivolumab未能比标准化疗延长无进展生存期。 按照之前对免疫检查点抑制剂的理解,PD-L1≥5%疗效还不好,这是难以置信的。不过它发生了,事实就摆在那里。研究人员认为,Checkmate-026失败的锅,不能让nivolumab背,背后肯定有其他原因。 于是他们又回过头去分析试验数据,发现TMB水平高的患者,用nivolumab进行治疗后,肿瘤缓解和生存获益的结果都显著优于化疗[3]First-Line Nivolumab in Stage IV or Recurrent Non–Small-Cell Lung Cancer。 TMB这才吸引了全世界的目光。 上面的两个回顾性研究表明,TMB可能是预测免疫治疗效果的优秀标志物。不过,如果是用全外显子测序评估肿瘤组织的TMB,这个成本恐怕会高的没人用的起。所以,这两个研究也没有引起太大的轰动效应。  Foundation Medicine, Inc(FMI)和MSKCC的努力让事情出现了转机。 其中FMI推出了FoundationOne(F1),这款产品分析数百个癌症相关基因的总计约1.1Mb大小的外显子序列,然后计算TMB水平。 大量的研究表明,以F1为代表的TMB检测与WES相比,一致性高[4]Comprehensive cancer-gene panels can be used to estimate mutational load and predict clinical benefit to PD-1 blockade in clinical practice [5]Targeted next generation sequencing identifies markers of response to PD-1 blockade [6]Molecular determinants of response to anti–programmed cell death (PD)-1 and anti–programmed death-ligand 1 (PD-L1) blockade in patients with non–small-cell lung cancer profiled with targeted next-generation sequencing。 2017年,FMI发布了接受F1检测的10万例患者数据分析[7]Analysis of 100,000 human cancer genomes reveals the landscape of tumor muta。数据显示,通过F1评估的TMB与全外显子(WES)测序一样准确。  此外,这个研究还全面评估了百余种癌症的TMB图谱,分析了TMB与MSI之间的关系。他们发现,83%的MSI-H同时也是TMB-H,且97%的MSI-H样本的TMB≥10 mut/Mb;只有16%的TMB-H样本同时为MSI-H。这也意味着,TMB可能比dMMR和MSI使用范围更广。 同年,约翰·霍普金斯大学的Elizabeth Marion Jaffee教授在分析了多个临床研究数据之后,得出结论[8]Tumor Mutational Burden and Response Rate to PD-1 Inhibition:TMB对27种肿瘤类型的免疫治疗有显著的预测作⽤,TMB与ORR之间存在显著相关性(P<0.001),相关系数为0.74,这意味着在这27种肿瘤中,55%的ORR差异可以用TMB来解释;凸显了TMB与抗PD-1治疗疗效之间存在强相关性。  基于前期的一系列高质量研究,FDA最终批准了FoundationOne CDx成为首个泛瘤种伴随诊断产品,它覆盖了324个基因,两个预测免疫检查点抑制剂疗效的分子标记MSI和TMB(TMB计算方法:0.8Mb编码区域里包含所有的同义突变和非同义突变,并去掉胚系突变和肿瘤驱动突变),覆盖全部实体瘤(除肉瘤)。 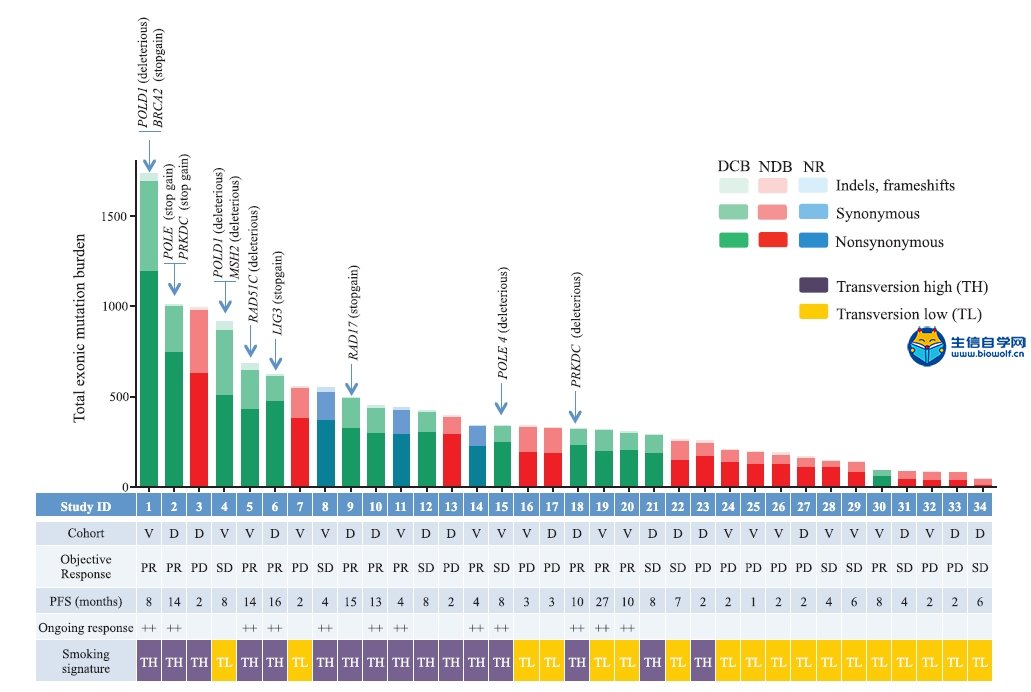 TMB的未来 到了2018年,证明TMB实力的前瞻性研究论文终于发表。 这项在非小细胞肺癌中开展的临床研究(CheckMate227),使用了FMI的伴随诊断产品FoundationOne CDx。结果表明:在TMB≥10 mut/Mb的晚期非小细胞肺癌患者中,与铂类双联化疗相比,nivolumab加低剂量ipilimumab治疗明显延长了1年的无进展生存率(42.6% vs 13.2%),翻了3倍多;无进展生存期也显著延长(7.2月 vs 5.4月)[9]Nivolumab plus Ipilimumab in Lung Cancer with a High Tumor Mutational Burden。 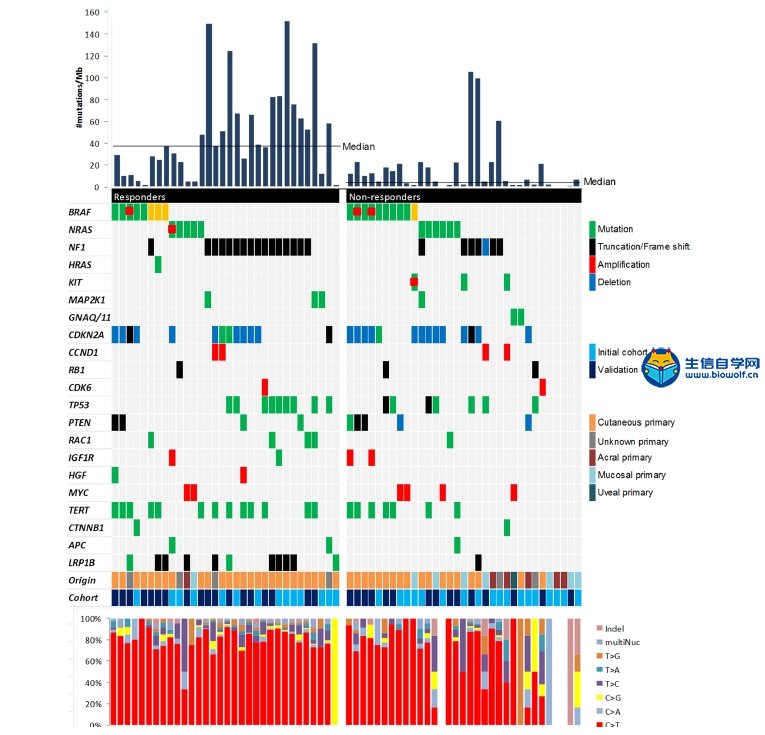 在刚刚闭幕的2018年欧洲肿瘤医学协会会议(ESMO)上,FMI的科学家又系统地分析了FoundationOne CDx计算的TMB与全外显子检测的匹配度。研究人员再次证实,只要临床组织样本中肿瘤细胞的含量能达到20%,FoundationOne CDx计算的TMB就能达到非常好的可重复性,可重现性,灵敏性和准确性。 这个研究结果是在全球范围内首次在III期临床试验中证实:无论PD-L1表达水平如何,只要非小细胞肺癌患者的TMB高,联合免疫治疗都能够给他们带来无进展生存期显著获益。也是首个证实TMB可以作为免疫治疗效果预测伴随诊断方法的前瞻性临床研究。 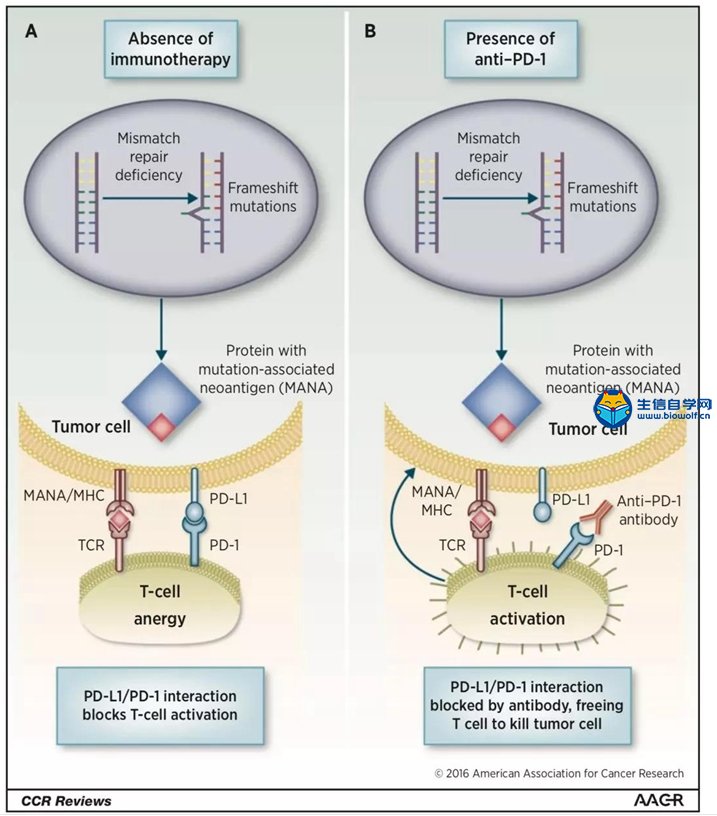 与此同时,另一项并列开展中的CheckMate568也表明,在接受nivolumab加ipilimumab治疗的非小细胞肺癌患者,TMB≥10 mut/Mb的患者中位无进展生存期几乎是TMB<10 mut/Mb患者的3倍(7.1月 vs 2.6月),无论PD-L1表达水平如何。 这两个研究奠定了TMB在预测免疫治疗效果中的地位。 正是基于这些研究成果,在今年刚刚推出的非小细胞肺癌NCCN指南中,TMB赫然在列,成为非小细胞肺癌患者接受免疫治疗的推荐检测方法。  尽管如此,TMB仍面临一些问题。从前面的临床研究中我们也不难看出,有些TMB非常高的患者对免疫治疗也没有反应,有些TMB低的患者使用免疫检查点抑制剂效果却很好。 这意味着,除了TMB之外,患者对免疫治疗的响应程度还与其他多种因素有关。这也提示,将TMB与其他的标志物联合使用可能会提升TMB的预测能力。 近日,Razvan Cristescu等在《科学》上发表的一项研究成果给了我们一定的启示:同时检测T细胞的活性水平和TMB可能是个不错的方向[10]Pantumor genomic biomarkers for PD1 checkpoint blockade–based immunotherapy。  此外,目前TMB检测主要还是基于肿瘤组织。然而,有很多患者没有足够的肿瘤组织可供使用,甚至有些患者还不适合做组织活检,在非小细胞肺癌里面就有近30%的患者是这样的状况[11]Biomarker testing and time to treatment decision in patients with advanced nonsmall-cell lung cancer。 日前,加州大学戴维斯分校综合癌症中心、基因泰克公司和FMI联合证实,血浆中肿瘤突变负荷(bTMB)可准确重复测量,并且与免疫检查点抑制剂疗效相关。证实了bTMB对免疫治疗药物疗效预测的有效性。 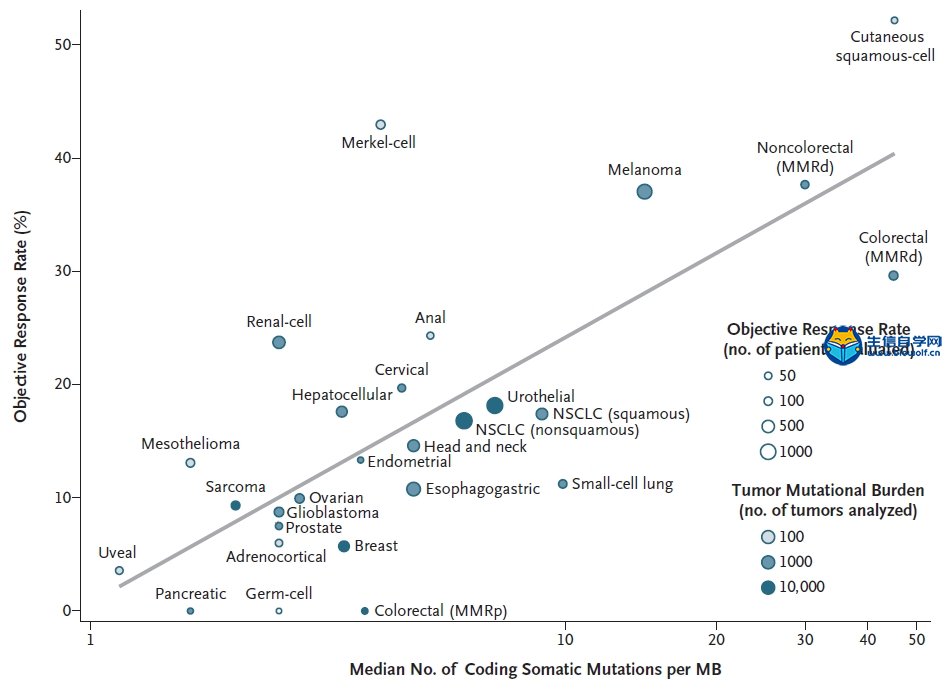 就在这个研究发表的数日后,来自宾夕法尼亚大学的华人学者Xu Xiaowei和Guo Wei发现,肿瘤内的癌细胞会产生携带压制T细胞活性的PD-L1的外泌体,这种外泌体从肿瘤组织中直接散播到全身各处,对人体的免疫系统进行全面的打击和压制[12]Exosomal PD-L1 contributes to immunosuppression and is associated with anti-PD-1 response。 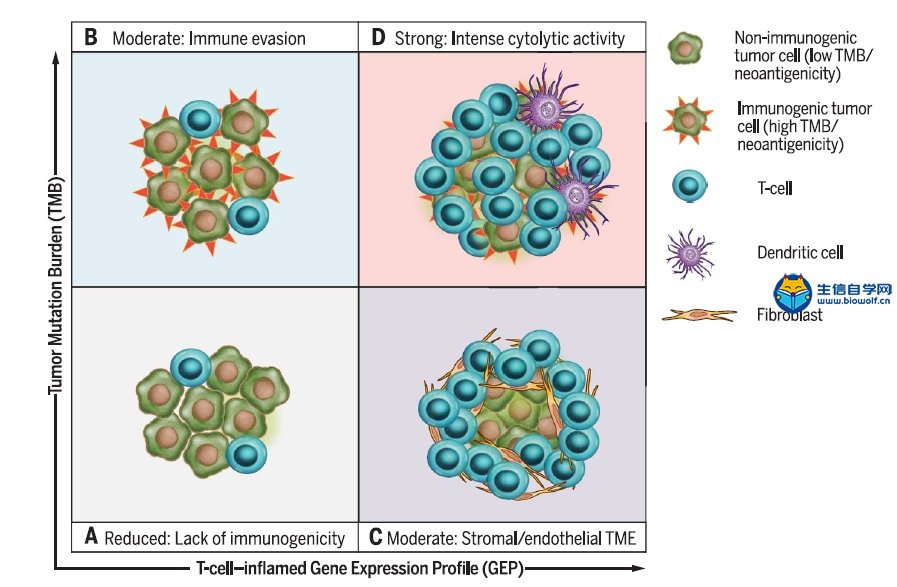 或许在不久的将来,医生可以直接从癌症患者身上抽一管血,就可以评估T细胞的活性和癌细胞的免疫原性,最终实现准确的判断患者对免疫治疗的反应。 生信自学课堂精品课程推荐: 《TCGA数据库肿瘤突变负荷TMB分析》 《m6A RNA甲基化分析》 《单基因挖掘套路基于TCGA数据库》 《单细胞测序数据挖掘》 
责任编辑:伏泽 作者申明:本文版权属于生信自学网(微信号:18520221056)未经授权,一律禁止转载! |





